1. Couches atmosphériques
1.1. Première classification
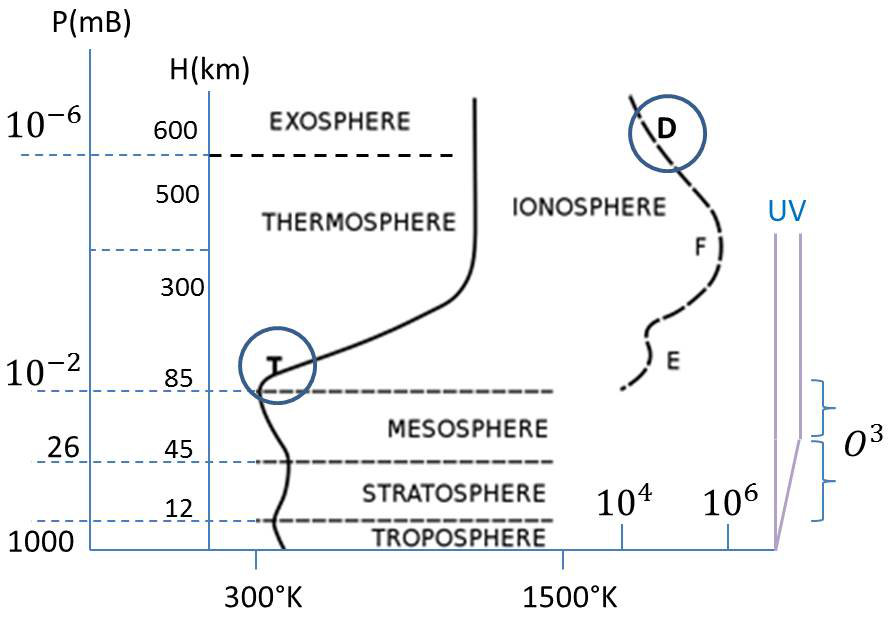 L’atmosphère est globalement divisée en cinq couches dont les limites ont été fixées selon les discontinuités dans les variations de la température, en fonction de l’altitude. Elles sont classées à partir du sol :
L’atmosphère est globalement divisée en cinq couches dont les limites ont été fixées selon les discontinuités dans les variations de la température, en fonction de l’altitude. Elles sont classées à partir du sol :
1.1.1. Basse atmosphère
a) La troposphère
Altitude maximum \(\approx\) 15 km ou tropopause dont le niveau dépend des conditions thermiques au sol : 6 à 8 km aux pôles et 15 à 18 km à l’équateur. La température y décroît avec l’altitude.
La pression diminue au fur et à mesure que l’altitude augmente. Selon la loi des gaz parfaits, la température diminue également. Elle atteint, dans la tropopause, une valeur voisine de –56,5 °C. On estime que cette décroissance est de l’ordre de 6,5 °C/km, ce qui donne bien au sol une température moyenne de l’ordre d’une quinzaine de degrés.
Cette couche contient 80 à 90 % de la masse totale d’air et la quasi-totalité de la vapeur d’eau.
C’est là que se produisent les phénomènes météorologiques (nuages, pluies, etc.) ainsi que les mouvements atmosphériques horizontaux et verticaux (convection thermique, vents). Le niveau de la tropopause est fonction des conditions de pression au sol, remontant à l’occasion d’anticyclones (hautes pressions) et redescendant lorsque se manifestent des dépressions.
b) La stratosphère
De 15 à 50 km d’altitude. La température croît avec l’altitude jusqu’à 0 °C. Avec la couche supérieure, la mésosphère, la stratosphère partage une bonne partie de la couche d’ozone \(O_3\).
c) La mésosphère.
De 50 à 85 km d’altitude. La température décroît avec l’altitude jusqu’à –80 °C.
1.1.2. Haute atmosphère
a) La thermosphère
De 80 à 600 km d’altitude (et au-delà). La température croît avec l’altitude, jusqu’à une valeur de l’ordre de 1 000 °C, puis se stabilise.
b) L’exosphère
Au-delà de 600 km d’altitude, c’est l’exosphère appelée aussi couronne de la Terre ou encore géocouronne. Passés les 500 km, les molécules sont à peu près toutes dissociées et la température se stabilise. En fait, le libre parcours moyen des atomes est devenu tellement grand et supérieur à la hauteur d’échelle (voir ci-dessous au § 2) que parler de gaz atmosphérique, de pression ou de température n’a plus vraiment de sens.
1.2. Une zone particulière : l’ionosphère
Une zone de l’atmosphère chevauche une petite partie de la mésosphère, englobe la thermosphère et l’exosphère pour s’étendre jusqu’à 1 000 km. Il s’agit de l’ionosphère, partie de l’atmosphère ionisée par les radiations solaires. Elle joue un rôle important dans l’électricité atmosphérique et forme le bord intérieur de la magnétosphère.
Grâce à ses particules chargées, elle a une importance pratique car elle influence, par exemple, la propagation des ondes radio sur la Terre (c’est par elle que Marconi réalisa une première communication intercontinentale). Elle est aussi le lieu où se déroulent les aurores.
1.3. Un bouclier
Ces cinq couches atmosphériques, véritables couronnes sphériques, entourent le globe terrestre, assurant un rôle protecteur par deux fonctions :
-
atténuation de la puissance directe des rayons solaires par réflexion et absorption à l’arrivée sur chacune des couches ;
-
filtrage par réactions chimiques diverses du rayonnement UV (ultraviolet) issu de la même source. D’où le rôle de la structure chimique de la couche.
2. Calcul élémentaire de pression
En première approche physique, la variation de pression au travers d’une couche d’air horizontale est proportionnelle à l’épaisseur de cette couche et à la densité de l’air (fonction de la composition de l’air) : \[\frac{dp}{dh}=-p~\frac{Mg}{RT} \quad \Rightarrow \quad \frac{dp}{p}=-\frac{Mg}{RT}~dh\] \(g\) : accélération de la pesanteur (\(g=9,807~m.s^{-2}\))
\(M\) : masse molaire des gaz (supposés parfaits) de l’atmosphère (\(M=0,02896~kg.mol^{-1}\))
\(R\) : constante des gaz parfaits (\(R=8,314~J.K^{-1}.mol^{-1}\))
\(T\) : température absolue (\(T~en~^oK=t~en~^oC+273,15\))
L’intégration classique (variables séparées), \(T\) étant supposé constant conduit à : \[\Delta p=\exp\Bigl\{-\frac{\Delta h}{h_c}\Bigr\}\]
\(h_c=RT~/~Mg\) est appelée altitude caractéristique (ou hauteur d’échelle).
Dans notre modèle et pour une température supposée constante de \(t=15~^oC\), cela signifie que, à chaque augmentation \(h_c=8,4~km\) d’altitude, la pression diminue d’un facteur \(e=2,71828\).
Remarque sur le facteur d’échelle
La pression décroît de moins en moins vite quand l’altitude augmente, le facteur d’échelle passant de 8,4 à 11,4 m environ au-delà de 3000 m. Au niveau de la mer, la hauteur d’échelle \(h_c\) est de l’ordre de 8,5 km.
L’hypothèse \(h_c=cte\) n’est valable que sur un intervalle d’altitude limitée. Cette échelle doit être calculée pour chaque gamme d’altitude en fonction des valeurs moyennes de la gravité, de la température et la masse moléculaire.
L’accélération de la pesanteur décroît relativement lentement en fonction de l’altitude \(z\) suivant un facteur : \[\lambda(z)=\left[\frac{R_0}{R_0+z}\right]^2 \qquad R_0~:~\text{rayon terrestre}\]
À titre indicatif, la masse moléculaire moyenne de l’air que nous respirons passe de la valeur \(28,96~g.mol^{-1}\) au niveau du sol à la valeur \(25,45~g.mol^{-1}\) à une altitude de 1 206 km, altitude appelée turbopause et correspondant à un équilibre de diffusion entre les gaz.
3. Physique et chimie de l’atmosphère
3.1. Troposphère
Rappelons d’abord la composition essentielle de l’air dans notre troposphère :
\[\begin{aligned} &&&\text{Azote moléculaire}&N_2&=78~\%&&\\ &&&\text{Oxygène moléculaire}&O_2&=21~\%&&\\ &&&\text{Argon}&Ar&=1~\%\end{aligned}\]
En traces :
\[\begin{aligned} &&&\text{Néon}&&Ne&&&& \text{Hélium}&&He&&&& \text{Méthane}&&CH_4&&\\ &&&\text{Hydrogène}&&H_2&&&& \text{Krypton}&&Kr&&&&\text{Xénon}&&Xe&&\end{aligned}\]
En quantité variable en fonction de l’activité industrielle :
\[\begin{aligned} &&&\text{Aérosols }(solides)\\ &&&\text{Oxydes de carbone }(CO_2,~CO)& &\text{Oxydes d'azote }(N_2O,~NO,~NO_2)\\ &&&\text{Ozone }(O_3)& & \text{Anhydride sulfureux }(SO_2)& & \text{Ammoniac }(NH_3)\\ &&&\text{etc.}\end{aligned}\]
Vapeur d’eau :
En proportions variables (inférieure à 5 %). Quantité maximale que l’air peut admettre étant d’autant plus élevée que la température est forte.
Le tableau ci-dessous donne une idée de la variation de cette répartition entre le niveau du sol et celui de la turbopause (altitude \(120~km\))
\[\begin{matrix} &H~(km)& &N_2^{28}&O_2^{32}&Ar^{40}&O^{16}& &M~(g.mol^{-1})\\ \\ &0& &78,08&20,95&0,93&...& &28,96\\ & & & & & & & & & \\ &120& &65,6&9,4&0,26&24,7& &25,45 \end{matrix}\]
Dans la basse troposphère, les molécules d’eau et de gaz carbonique absorbent une partie du rayonnement infrarouge (IR), ce qui contribue à réchauffer partiellement l’air.
Parfois, par temps chaud et calme, un phénomène d’inversion de température peut se produire : au voisinage du sol, la température est localement plus basse que quelques centaines de mètres plus haut. Les mouvements convectifs sont alors contrariés et les polluants restent piégés au ras du sol d’où un brouillard .
3.2. Stratosphère
La composition de l’air stratosphérique reste voisine de celle de l’air troposphérique. Les poussières solides et la vapeur d’eau sont rares, mais on observe encore quelques nuages.
L’augmentation de température est de l’ordre de 1,5 °C par km. Elle est imputable au rayonnement UV solaire, absorbé par les molécules de l’air lors de réactions chimiques.
Naissance de la couche d’ozone
Les molécules d’oxygène (\(O_2\)) sont photo-dissociées par le rayonnement UV. L’air étant encore assez dense, les molécules d’oxygène entrent en collision avec les atomes créés lors d’autres collisions. Il apparaît ainsi une molécule d’ozone (\(O_3\)), constituée de trois atomes d’oxygène.
Cet ozone est ensuite partiellement détruit à son tour, soit par réaction avec de l’oxygène, soit avec des oxydes d’azote ou d’autres molécules,. soit par photo-dissociation sous l’effet d’un photon de longueur d’onde inférieure à 0,35 \(\mu\)m.
Un certain équilibre s’établit entre les diverses réactions chimiques et une couche d’ozone se forme, présentant un maximum de concentration dans la stratosphère. Cette concentration reste toutefois faible, inférieure à 1 molécule d’\(O_3\) pour \(10^6\) molécules d’\(O_2\).
L’ozone, en tant que tel, est un gaz nocif, mais cette couche d’ozone stratosphérique est essentielle pour notre survie : par sa capacité d’absorption des UV (surtout ceux dont la longueur d’onde est comprise entre 0,2 et 0,3 \(\mu\)m), elle constitue une barrière contre les rayonnements solaires nocifs et interdit à ces UV d’atteindre le sol.
3.3. Mésosphère
La mésosphère est le siège d’une grande activité chimique. Elle est la première région dans laquelle des ions et des électrons apparaissent en proportion non négligeable, et ce phénomène va s’amplifier dans la haute atmosphère. Les molécules d’oxygène, d’eau, d’hydrogène, d’oxydes d’azote et d’ozone sont partiellement dissociées et les produits formés réagissent entre eux.
Le rayonnement solaire à 0,12 \(\mu\)m (raie de l’hydrogène solaire) est très intense. Son énergie est suffisante pour parvenir à ioniser certaines molécules. Bien que la pression y soit très faible (0,1 mbar à 65 km et 0,01 mbar à 80 km), il subsiste plus de \(10^{14}\) atomes ou molécules par cm³ dans cette partie de l’atmosphère.
3.4. Thermosphère
Entrée dans la très haute atmosphère. De 80 à 300 km environ, selon la figure, la température croît puis se fige à 1 000 °C. À partir de ce point et jusqu’à ses confins, l’atmosphère est isotherme et raréfiée ou neutre. Les notions intuitives de température perdent leur sens. Les explications données par la physique théorique ne sont pas facilement transposables ici.
Nous dirons que du fait de la raréfaction du milieu, les collisions entre particules y sont plus rares et que tout se passe comme s’il devait y régner un grand froid. La température se maintient du fait que l’absorption d’énergie solaire est intense. Les rayons X ou UV (\(\lambda < 0,18~\mu\)m) sont presque tous arrêtés, dissociant, ionisant ou excitant les constituants atmosphériques.
L’énergie émise par le Soleil augmente en période de forte activité solaire (taches présentes à la surface du Soleil nombreuses et importantes). La température limite atteinte dans la thermopause varie donc sensiblement. La Terre est heureusement bien protégée de ces fluctuations importantes par les couches atmosphériques superposées qui jouent le rôle d’amortisseurs.
Sous l’effet du rayonnement solaire énergétique, une photo-dissociation systématique de toutes les molécules se produit. L’oxygène se dissocie surtout vers 100 km d’altitude alors que l’azote se dissocie plus lentement. Il s’instaure en fait un certain état d’équilibre, déterminé par les probabilités et les vitesses des différents processus.
Les gaz présents au sommet de l’atmosphère sont nécessairement les plus légers. Ainsi, alors que l’azote moléculaire (masse relative 28) reste majoritaire jusqu’à 200 km environ, c’est l’oxygène atomique (masse relative 16) qui devient ensuite le constituant principal.
Au-delà de la thermopause deux nouveaux éléments apparaissent : l’hélium (masse relative 4), puis l’hydrogène (masse relative 1) qui devient donc l’unique constituant aux confins de l’atmosphère.
3.5. Exosphère
Vers 1 000 km d’altitude, l’hélium \(He\) est prédominant. Au-delà, on trouvera surtout des atomes d’hydrogène \(H\), encore plus légers, et des ions d’hydrogène \(H^+\), c’est-à-dire des protons.
Dans cette très haute atmosphère terrestre, l’hydrogène provient de la photo-dissociation de l’hydrogène moléculaire \(H_2\), de la vapeur d’eau \(H_2O\) et du méthane \(CH_4\). À 1 000 km d’altitude, il y a plus de 6 000 atomes d’hydrogène par cm³. À 10 000 km, il y en a encore plus de 1 000. À 70 000 km, il en reste encore une dizaine. Ces concentrations ont été déduites des observations de raies dans le visible et dans le rayonnement UV.
Les particules exosphériques ne sont soumises qu’au champ de gravitation et au champ magnétique terrestre. En négligeant l’effet de la pression de radiation solaire, on peut dire que les particules peuvent suivre trois types de trajectoires :
-
des trajectoires balistiques qui les font retomber dans la thermosphère ;
-
des trajectoires de satellisation autour de la Terre (pour les particules ionisées, des trajectoires de piégeage de type hélicoïdal le long des lignes de champ magnétique) ;
-
des trajectoires hyperboliques leur permettant d’échapper définitivement à l’environnement terrestre.

