1. Les origines
L’origine des principales substances qui contaminent l’atmosphère est très variée. On sait que la cause principale est l’usage des combustibles fossiles comme source d’énergie. Mais il existe d’autres causes de contamination de la biosphère, déjà évoquées. Les deux modalités d’émission de pollution atmosphérique correspondent respectivement : le premier à des sources de pollution ponctuelles, le second à des pollutions diffuses.
Les premières sont par exemple les cheminées d’usines (aéropolluants des centrales thermiques au charbon ou au fuel, installations métallurgiques) ou des sites d’industries chimiques concentrés sur une aire restreinte.
À l’opposé, il existe une multitude de causes de pollution diffuse : échappements des véhicules à moteurs, des incinérations sauvages de déchets (domestiques ou industriels), dispersés dans la nature, épandages de pesticides sur les cultures, entraînement par le vent de particules de sols souillés par des contaminants chimiques, etc.
Cette distinction entre pollutions ponctuelles et pollutions diffuses concerne aussi les polluants des eaux.
2. Principaux polluants atmosphériques
L’atmosphère actuelle résulte en définitive de l’action continue des êtres vivants depuis les débuts des temps géologiques. Malgré la constance de sa composition, celle-ci ne reflète qu’un équilibre dynamique, métastable, résultant de l’action antagoniste des divers agents biogéochimiques en particulier ceux des organismes autotrophes et hétérotrophes.
L’air pur homogène n’existe pas puisque des échanges s’effectuent en permanence entre les êtres vivants, l’hydrosphère, l’atmosphère, les couches superficielles et profondes de la lithosphère (volcanisme).
La masse totale de l’atmosphère est de 5,2 10\(^{10}\) milliards de tonnes. Ses 9/10 sont situés au-dessous de 16 km d’altitude (troposphère) alors que les couches supérieures au-delà de 48 km d’altitude ne renferment que 1/1 000 de cette masse.
Composition de l’air sec (d’après Valley)
| Constituants | % (volume) | % (masse) | |
| Azote | 78,01 | 75,53 | |
| Oxygène | 20,95 | 23,14 | |
| Argon | 0,93 | 1,28 | |
| Dioxyde de carbone | 0,037 | 0,052 | |
| Néon | 1,8 10\(^{-3}\) | 1,25 10\(^{-3}\) | |
| Hélium | 5,24 10\(^{-4}\) | 7,24 10\(^{-5}\) | |
| Méthane | 1,7 10\(^{-4}\) | 9,41 10\(^{-5}\) | |
| Krypton | 1,14 10\(^{-4}\) | 3,3 10\(^{-4}\) | |
| Protoxyde d’azote | 5 10\(^{-5}\) | 7,6 10\(^{-5}\) |
2.1. Tableau de synthèse des principaux polluants
État Gazeux
| - Dioxyde de carbone (\(CO_2\)) | - Volcanisme, | |
| respiration des êtres vivants, | ||
| combustibles fossiles | ||
| - Oxyde de carbone (\(CO\)) | - Volcanisme, | |
| moteurs à explosion | ||
| - Hydrocarbures | - Plantes vertes, bactéries, | |
| moteurs à explosion | ||
| - Composés organiques | - Industries chimiques, | |
| incinérations d’ordures, | ||
| combustions diverses | ||
| - Dioxyde de soufre (\(SO_2\)), | - Bactéries, embruns marins, | |
| autres dérivés soufrés | combustibles fossiles, | |
| volcanisme | ||
| - Oxydes d’azote (\(NO_x\)), | - Bactéries, | |
| autres dérivés nitrés | combustions diverses, | |
| moteurs à explosion | ||
| - Radionucléides | - Industrie nucléaire, | |
| explosions (tests, accidents) |
État particulaire
| - Métaux toxiques, | - Volcanisme, météorites, | |
| composés inorganiques | érosion éolienne, embruns marins, | |
| industries diverses, | ||
| moteurs à explosions | ||
| - Composés organiques | - Industrie chimique, | |
| (naturels ou de synthèse) | incinération d’ordures, | |
| combustions, agriculture (pesticides) | ||
| - Radionucléides | - Industrie nucléaire, | |
| explosions (tests, accidents) |
2.2. Polluants gazeux
2.2.1. Dérivés du carbone
a) Le dioxyde de carbone \(CO_2\)
Tout d’abord, un constat intéressant (Kempe in Bolin) : la production produite par la respiration de l’ensemble des êtres vivants terrestres est de l’ordre de 10,9 10\(^{10}\) tonnes annuelles contre 11 10\(^{10}\) tonnes absorbées par l’ensemble des producteurs primaires de la biosphère (photosynthèse). Un bel équilibre naturel.
Selon certaines études, on estime aux environs de 25 milliards de tonnes (ou 2,5 10\(^{10}\)) les quantités totales d’origine technologique de ce gaz rejetés dans l’atmosphère à l’heure actuelle, (24,4 pour les rejets globaux en 2000). Chiffre non négligeable comparés aux échanges naturels et équilibrés mentionnés plus haut. Ce qui signifie que le problème est sérieux et que la porte de la recherche est grande ouverte sur les moyens techniques d’éliminer ce surplus de \(CO_2\).
Rappelons-nous une bonne vieille équation de chimie :
\[\begin{aligned} &C~+~O_2\rightarrow CO_2 \qquad \text{avec}\quad C~=~12 \quad ; \quad O~=~16\end{aligned}\]
La combustion de 12 g de carbone produit 44 g de \(CO_2\). On conçoit aisément que les quantités de gaz carbonique générées par l’oxydation de telles masses de charbon et d’hydrocarbure fossiles soient considérables.
b) Le monoxyde de carbone \(CO\)
Le volcanisme, certaines fermentations en milieu anaérobie, les décharges électriques dans la troposphère, les incendies de forêts, les feux de brousse représentent les principales sources naturelles et artificielles de monoxyde de carbone. Des êtres vivants marins semblent intervenir de façon significative dans la production naturelle de ce gaz (algues brunes). Ces diverses sources biologiques sont la cause essentielle de la présence de ce gaz à saturation dans les eaux océaniques.
Les principales sources technologiques proviennent des combustions : charbons et fuels, incinération des déchets urbains et émission des véhicules à moteur. Avant la génération des pots catalytiques, ces derniers constituaient la principale source d’émanation de ce gaz.
La concentration atmosphérique de monoxyde de carbone varie beaucoup dans les basses couches de l’atmosphère selon la localisation géographique. Elle est redoutable dans les carrefours et les embouteillages, jusqu’à 100 ppm, à la limite du seuil de nocivité.
On a pu mettre en évidence des concentrations anormalement élevées dans les stations de sports d’hiver en altitude élevée. Comme les automobiles sont réglées pour fonctionner au niveau de la mer, elles émettent 4 fois plus de monoxyde de carbone à 2 500 m.
Comme techniques d’élimination de la troposphère de ce composé, certains processus biogéochimiques qui décomposent ce gaz et le transforment en d’autres composés sont très efficaces. La principale voie de neutralisation abiotique du \(CO\) tient en son oxydation en gaz carbonique par réaction avec un hydroxyle : \[CO~+~OH \rightarrow CO_2~+~H^+\]
Cette réaction interviendrait de façon prépondérante dans le cycle du monoxyde de carbone atmosphérique. Elle semble à tout le moins jouer un rôle significatif dans l’atmosphère tropicale par suite du haut niveau de rayonnement UV propre à ces zones.
On a pu montrer aussi que diverses bactéries au sol absorbent le \(CO\) et le transforment en \(CO_2\) ou en méthane.
c) Les hydrocarbures
Le méthane \(CH_4\) est naturellement présent en gaz dans l’atmosphère. Il en existe des quantités considérables dans la lithosphère, car c’est le constituant majeur des gisements fossiles de gaz naturel.
Depuis le début de l’ère industrielle, l’accroissement de la teneur atmosphérique a pris une allure exponentielle. Mais considérant le seul accroissement à partir de ce point, en fonction de la population mondiale, la tendance est homothétique. Quelques éléments : à l’époque médiévale, elle était inférieure à 0,65 ppm pour passer à 0,8 ppm dans les années 1800 et se retrouver à 1,9 ppm dans les années 2000. Entre temps, la population mondiale passait de 0,5 à 1 milliard, puis à 5 milliards d’habitants.
Les autres hydrocarbures ne seront cités que pour mémoire :
Les terpènes, produits par de nombreuses plantes, en particulier les conifères, sont des composants majeurs de la résine et de l’essence de térébenthine produite à partir de résine. La formule de base est un multiple de \((C_5H_8)_n~;~n\neq 1\). Rien à voir avec l’isoprène \(C_5H_8\) dans sa construction moléculaire. En revanche, l’isoprène est facilement obtenu par dégradation des terpènes.
Les hydrocarbures aromatiques polycycliques (HAP) dont la molécule est constituée par la fusion d’un nombre variable de cycles benzéniques. Le plus simple d’entre eux est le naphtalène (\(C_{10}H_8\)). En origine naturelle, on les trouve autant dans les biotopes terrestres que aquatiques (continentaux et océaniques). Les HAP sont contenus dans les goudrons et les suies rejetés par les divers foyers : fumées émises par les installations de raffinage du pétrole, les chaufferies industrielles au charbon et au fuel, échappements des moteurs diesels (surtout les fumées noires). Le montage des pots catalytiques a permis de les éliminer presque complètement.
Beaucoup de HAP sont de redoutables cancérigènes en particulier le benzo(a)pyrène. Il se rencontre aussi dans la fumée de cigarette, étant à ce titre la principale cause des cancers de la gorge et du poumon des fumeurs.
2.2.2. Dérivés du soufre
Le volcanisme et les embruns marins sont les principales sources naturelles abiotiques d’introduction des dérivés inorganiques gazeux et particulaires du soufre dans l’atmosphère. Il existe d’autres causes spontanées qui apportent à l’atmosphère des composés du soufre. Parmi elles, l’érosion éolienne en milieu continental peut jouer un rôle significatif.
Les principaux aéropolluants gazeux dérivés du soufre sont le dioxyde de soufre, l’hydrogène sulfuré et, au voisinage de certaines industries chimiques, des thiols appelés encore mercaptans (qui captent le mercure). Ces derniers confèrent à l’air cette odeur alliacée caractéristique au voisinage des raffineries de pétrole. Formule chimique du type \(R-SH\), par exemple le méthanéthiol \(CH_3-SH\).
Dioxyde de soufre \(SO_2\)
Le dioxyde de soufre se rencontre dans l’air à l’état de traces infinitésimales en l’absence de toute source de pollution. On estime que sa concentration moyenne dans la troposphère des zones les plus reculées est comprise entre 0,01 et 0,2 ppm.
La principale cause de pollution atmosphérique par le dioxyde de soufre réside dans les combustions, plus particulièrement celles liées à l’usage des combustibles fossiles (à forte teneur en soufre), exception faite du gaz naturel. Parmi les dérivés pétroliers, il s’agit du gazole, mais surtout des fuels renferment du soufre. En France, la réglementation tolère 0,3 % de soufre dans les fuels domestiques, 1,8% dans les fuels légers et plus de 3 % dans les fuels lourds (industriels).
Les incendies de forêt, et plus généralement ceux du couvert végétal, introduisent aussi du \(SO_2\) dans l’atmosphère.
La métallurgie des métaux non ferreux représente la seconde cause de pollution de l’air par le dioxyde de soufre. Cela provient du fait que le minerai dont on extrait la plupart de ces métaux est constitué de pyrites dont la formule générale est \(M_xS_y\). La première étape de l’extraction du métal consiste en un grillage qui est une oxydation de la pyrite : \[CuS~+~\frac{3}{2}O^2\quad\rightarrow\quad CuO~+~SO_2\]
Le rapport des masses molaires montre qu’on obtient 60 % de masse de \(SO_2\), ce qui est relativement important. Enfin, diverses industries chimiques comme celles de la synthèse de l’acide sulfurique peuvent être sources de contamination en l’absence de mesures adéquates de protection.
Le \(SO_2\) émis dans l’atmosphère n’y demeure pas indéfiniment, car il y subit diverses transformations qui font partie du cycle biogéochimique naturel du soufre dans la biosphère. Par exemple, en présence de lumière UV, le dioxyde de soufre est transformé en anhydride sulfurique suivant la réaction :
\[\begin{aligned} &SO_2~+~\frac{1}{2}O_2\quad\rightarrow\quad SO_3~+~22~kcal\\ &SO_3~+~H_2O\quad\rightarrow\quad H_2SO_4\end{aligned}\]
Dans un cas comme dans l’autre, l’acide sulfurique formé, très hygroscopique, forme des brouillards responsables de la toxicité des smogs acides qui apparaissent dans les atmosphères urbaines polluées sous un climat tempéré froid et humide. Cet acide est aussi la cause majeure du phénomène des précipitations acides qui affecte de nos jours d’immenses surfaces dans l’hémisphère Nord tempéré.
Ce phénomène des pluies acides présente de graves conséquences pour les écosystèmes aquatiques et forestiers situés sur des terrains cristallins. L’acide sulfurique présent dans l’atmosphère réagit ensuite avec l’ammoniac et d’autres cations de divers métaux donnant des sulfates solides, souvent solubles dans l’eau qui sont ramenés au sol par des précipitations. Il a été démontré qu’en règle générale, l’acidité forte des pluies est due pour 72 % à l’acide sulfurique et à 28 % pour l’acide nitrique.
Hydrogène sulfuré \(H_2S\)
L’odeur forte de ce gaz est connue pour être celle de l’œuf pourri. Il est produit par diverses fermentations anaérobies, œuvre de sulfobactéries, tant en milieu terrestre que marin. Très toxique, sa concentration maximale admissible dans l’air est de 15 ppm. Il s’oxyde spontanément en \(SO_2\) dans l’atmosphère selon un processus complexe.
2.2.3. Dérivés de l’azote
Il existe plusieurs types d’aéropolluants azotés. La plupart, tels les oxydes d’azote \(NO_x\), l’ammoniac \(NH_3\) ou encore des constituants particulaires (microcristaux de nitrate ou de sulfate d’ammonium propres aux dépôts secs), sont aussi des constituants naturels présents dans l’atmosphère. D’autres, tels les PAN (peroxy-acyl-nitrates) sont entièrement d’origine anthropique et constituent des polluants tertiaires.
a) Les oxydes d’azote
On compte parmi les oxydes d’azotes le protoxyde d’azote, encore dénommé oxyde nitreux \(N_2O\), le monoxyde d’azote \(NO\) et le dioxyde d’azote \(NO_2\), encore appelé peroxyde d’azote.
Le protoxyde d’azote \(N_2O\)
Le protoxyde d’azote est le plus abondant dans les atmosphères non polluées avec une concentration moyenne de 0,25 ppm. C’est un puissant gaz de serre, car son potentiel de réchauffement climatique est 290 fois supérieur à celui du \(CO_2\) de sorte que ses dégagements interviennent dans les changements climatiques globaux dus à la pollution atmosphérique par ses rejets.
En revanche, en dépit de ses effets neurotropes (gaz hilarant) et anesthésiants à fortes doses, ce dernier ne joue pas de rôle majeur dans la pollution atmosphérique urbaine. La principale source technologique de \(N_2O\) dans l’atmosphère provient de la dénitrification des nitrates utilisés à vaste échelle comme engrais chimique et concerne donc l’espace rural. Le dioxyde d’azote \(NO_2\)
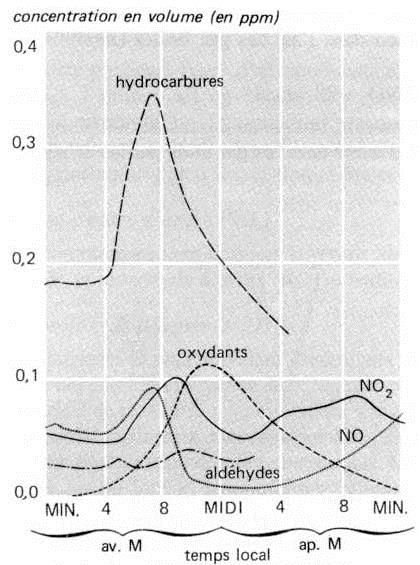 Le dioxyde d’azote est l’un des polluants majeurs de l’air, d’une importance fondamentale. Gaz stable, fortement coloré en jaune, il réduit de beaucoup la visibilité atmosphérique, conférant dans la plupart des cas une coloration brunâtre caractéristique aux masses d’air qui recouvrent les zones urbanisées.
Le dioxyde d’azote est l’un des polluants majeurs de l’air, d’une importance fondamentale. Gaz stable, fortement coloré en jaune, il réduit de beaucoup la visibilité atmosphérique, conférant dans la plupart des cas une coloration brunâtre caractéristique aux masses d’air qui recouvrent les zones urbanisées.
Ses propriétés physiques particulières se traduisent par une forte absorption des UV dans la bande 300 - 400 nm, provoquant sa dissociation par l’énergie lumineuse absorbée selon la réaction : \[NO_2~+~h\nu\quad\rightarrow\quad NO~+~O^{2-}+~72~kcal\]
Cette réaction engendre une pollution de l’air dite photochimique, car générée par l’exposition aux rayonnements du \(NO_2\) et de ses produits de décomposition avec d’autres contenus dans l’air pollué : dioxyde de soufre, oxygène, hydrocarbures. Parmi les diverses substances formées, certaines comme les PAN, sont phyto-toxiques et très irritantes pour la conjonctive.
2.2.4. Dérivés de l’ozone
a) Ozone troposphérique
L’ozone \(O_3\) (trioxygène) est une variété allotropique de l’oxygène, bien moins stable que le dioxygène \(O_2\), en lequel il tend naturellement à se décomposer. \[2~O_3\quad\rightarrow\quad 3~O_2\]
Gaz bleu pâle et incolore à température ambiante, il se démarque par son odeur caractéristique qui rappelle l’eau de Javel.
En présence d’humidité, il oxyde tous les métaux à l’exception de l’or, du platine et de l’iridium. Il agresse les cellules vivantes et peut être responsable de phénomènes de corrosion accélérée de polymères.
L’ozone est naturellement présent dans l’atmosphère terrestre. Entre 13 et 40 km d’altitude (stratosphère), une couche d’ozone se forme ; elle intercepte plus de 97 % des UV du Soleil. Ce gaz reste cependant un polluant dans les basses couches de l’atmosphère (troposphère) où il agresse le système respiratoire (il provoque la toux) et peut brûler les végétaux les plus sensibles. Son odeur est vite perceptible dans les endroits confinés où règne un champ électrique important (transformateur haute tension, échelle de Jacob, tubes UV, allume-gaz).
Dans la basse troposphère, l’accroissement de la teneur en ozone provoqué par la pollution atmosphérique résulte en particulier de la présence simultanée d’hydrocarbures imbrûlés et d’oxydes d’azote dans l’air urbain. Rappelons quelques formules :
\[\begin{aligned} CO~+~2O_2\quad&\rightarrow\quad CO_2~+~O_3\\ CH_4~+~4~O_2+(h\nu)\quad&\rightarrow\quad CH_2O~+~H_2O~+~2~O_3\end{aligned}\]
Le formaldéhyde formé (2° réaction) peut entrer dans un nouveau cycle d’oxydation, produisant à son tour de l’ozone qui réagit avec les aéropolluants et donne des polluants tertiaires.
b) Ozone stratosphérique
La couche d’ozone troposphérique évoque ce bouclier protecteur de la biosphère menacé par d’autres phénomènes de pollution . L’ozone se forme spontanément dans la haute stratosphère par réaction de l’oxygène moléculaire avec des rayons UV selon les réactions suivantes :
\[\begin{aligned} O_2~+~(h\nu)\quad&\rightarrow \quad 2~O^{2-}\\ O_2~+~O^{2-}\quad&\rightarrow \quad O_3~+~1~eV\end{aligned}\]
Couche d’ozone
Les divers aéropolluants rejetés dans l’atmosphère contribuent à la dégradation de la couche d’ozone. Certains le font de manière naturelle comme les oxydes d’azote, les chlorures de méthyle et de diméthyle qui se forment dans les océans, ainsi que l’iodure et le bromure de méthyle. Cependant, ce dernier est aussi libéré pour être utilisé à vaste échelle pour de nombreuses applications industrielles et agricoles.
À l’opposé, le rejet dans l’atmosphère d’autres substances, comme les CFC ou les halons, très nocives pour l’ozone stratosphérique, est strictement d’origine technologique. Les réactions de destruction de l’ozone par les CFC, par exemple avec le fréon, sont les suivantes :
\[\begin{aligned} CFCl_3\quad&\rightarrow \quad CFCl_2+Cl\\ 2~Cl~+~O_3\quad&\rightarrow \quad Cl_2O~+~O_2\end{aligned}\]
Par suite de l’introduction de ces divers polluants dans la stratosphère, il est apparu au milieu des années 1980 un trou dans l’ozone stratosphérique antarctique. Précisons tout de suite que par trou, il faut entendre en réalité une diminution d’épaisseur, répartie sur une surface plus ou moins grande.
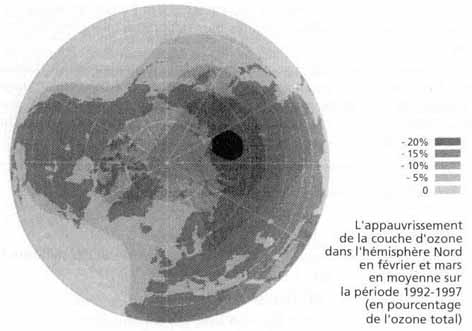 Depuis le début des années 1960, on a observé une tendance générale à la baisse continue en ozone stratosphérique non seulement dans l’atmosphère antarctique, mais également dans l’ensemble de la stratosphère à l’exception des latitudes tropicales. La baisse moyenne pour l’ensemble du monde a été de 5 % entre 1979 et 1995 et de 7 % pour les moyennes latitudes.
Depuis le début des années 1960, on a observé une tendance générale à la baisse continue en ozone stratosphérique non seulement dans l’atmosphère antarctique, mais également dans l’ensemble de la stratosphère à l’exception des latitudes tropicales. La baisse moyenne pour l’ensemble du monde a été de 5 % entre 1979 et 1995 et de 7 % pour les moyennes latitudes.
Un autre trou est apparu aux latitudes subarctiques et arctiques de l’hémisphère boréal au début des années 1990. Voir figure ci-contre (mesures entre 1992 et 1997).
Des recherches ont été effectuées à l’aide de diverses technologies : ballons sonde, par laser ou lidar (light detection and ranging). Elles ont montré que cette diminution de la teneur en ozone stratosphérique était nettement corrélée avec les rejets dans l’atmosphère de divers composés dégradant l’ozone, en particulier les CFC.
2.2.5. Dérivés halogénés
L’industrie chimique représente de façon directe ou indirecte une importante source d’émission de composés halogénés minéraux et organiques. L’électrochimie de l’alumine constitue une importante cause de pollution fluorée.
Une importante source de pollution atmosphérique par les composés organiques résulte de l’usage à vaste échelle de solvants chlorés (dichloréthane, chlorure d’éthylène).
Une autre cause importante de pollution de l’air par des composés halogénés minéraux ou organiques résulte de la combustion incomplète de certaines matières plastiques dans les incinérateurs d’ordures, plus particulièrement des PCV. Lorsque l’incinération se fait dans des conditions où l’oxygène est déficitaire, il s’effectue une pyrolyse dégageant du monomère, voire d’importantes quantités d’acide chlorydrique. De façon générale, l’incinération incomplète de nombreux composants organochlorés, très thermostable, conduit à les volatiliser dans l’atmosphère.
2.3. Polluants particulaires ou aérosols
Ces poussières constituent la seconde catégorie des polluants atmosphériques et un aspect majeur de la contamination par les activités humaines. Cependant, de nombreux phénomènes naturels, géophysiques ou géochimiques, sont aussi d’importantes sources naturelles d’aérosols : érosion éolienne, volcanisme, embruns marins.
2.3.1. Principaux types de particules polluant l’atmosphère
Les divers aérosols polluant l’atmosphère comportent des particules solides (poussières) ou liquides dispersées dans l’air par les diverses activités humaines. Elles peuvent être classées le plus simplement par ordre de taille décroissante en catégories distinctes.
a) Les grosses particules sédimentables
Elles mesurent en moyenne 20 \(\mu m\) et se localisent dans les basses couches de la troposphère, au-dessous de 3 000 m d’altitude, et retombent rapidement au voisinage de leur source d’émission dans les conditions météorologiques usuelles. Elles prédominent dans l’atmosphère des agglomérations fortement industrialisées.
b) Les particules semi-fines
Elles ont une taille comprise entre 2,5 et 0,1 \(\mu m\). Au-dessous de la taille minimum, la sédimentation spontanée des particules n’est plus possible par suite du mouvement brownien qui leur confère une accélération supérieure à celle de la gravitation.
Les particules solides de taille inférieure à 1 \(\mu m\) sont très importantes au point de vue météorologique. Elles constituent des noyaux de condensation très efficaces pour la vapeur d’eau atmosphérique.
Sur un plan sanitaire, ce sont les plus redoutables, car au-dessous de ce diamètre, elles peuvent pénétrer au travers de l’arbre bronchique jusqu’au fond des alvéoles pulmonaires.
On considère que la majorité de ces particules rejetées par l’homme dans l’atmosphère ont une taille comprise entre 0,1 et 20 mm. De ce fait, elles jouent un rôle très important dans les principaux phénomènes atmosphériques par suite de leur pouvoir de diffusion des radiations, lequel interfère avec de nombreux facteurs écologiques de première importance (éclairement, température au sol, précipitations par exemple).
c) Les particules insédimentables
Elles constituent les plus petits éléments des aérosols atmosphériques. Leur taille peut descendre jusqu’à 10 Å. Elles se rencontrent dans toute l’atmosphère mais leur concentration décroît très vite au-delà de la tropopause. Bien qu’elles soient intrinsèquement insédimentables, par suite de leur faible taille, elles sont malgré tout ramenées au sol par dilution ou entraînement mécanique par les précipitations et par des phénomènes électrostatiques qui conduisent à leur agglomération en certaines circonstances.
d) Les brouillards
Il s’agit d’aérosols atmosphériques au sens strict qui apparaissent dans diverses situations météorologiques naturelles. En effet, ils sont constitués de micro-gouttelettes d’eau souvent en surfusion, en suspension dans l’air, plus rarement de microcristaux de glace, de taille généralement inférieure au micron qui se forment par temps calme lorsque l’air est saturé de vapeur d’eau.
On a constaté néanmoins de longue date une augmentation considérable de la fréquence des épisodes où se forment des brouillards : elle est apparue très directement liée à la pollution atmosphérique. On les appelle des smogs contraction du mot anglais smoke ou fumée et fog ou brouillard. En milieu urbain et de façon plus générale en zone polluée, les micro-gouttelettes de brouillard fixent par dissolution de nombreux aéropolluants gazeux mais aussi des particules insédimentables voire semi-fines de faible taille. En zone rurale, les brouillards fixent de nombreux pesticides qu’ils dispersent ensuite dans l’environnement.
2.3.2. Répartition des aérosols
a) En altitude
D’une façon générale, on constate que les particules présentes dans la haute atmosphère sont d’origine naturelle et que la densité d’aérosols provenant des pollutions et autres actions de l’Homme sur l’environnement s’accroît dans la stratosphère puis dans la troposphère au fur et à mesure que l’on se rapproche de la surface. L’action de l’homme est très significative, au voisinage du sol, dans l’accroissement de la turbidité de l’air. Les aérosols stratosphériques sont essentiellement d’origine stratosphérique.
La couche d’aérosols stratosphériques renferme en sus des particules provenant des météorites ou du volcanisme, des microcristaux de sulfates d’ammonium. Ce dernier se forme à partir de l’hydrogène sulfuré du \(SO_2\), après oxydation de ces composés, par réaction avec l’ammoniac atmosphérique.
b) Répartition des aérosols en latitude
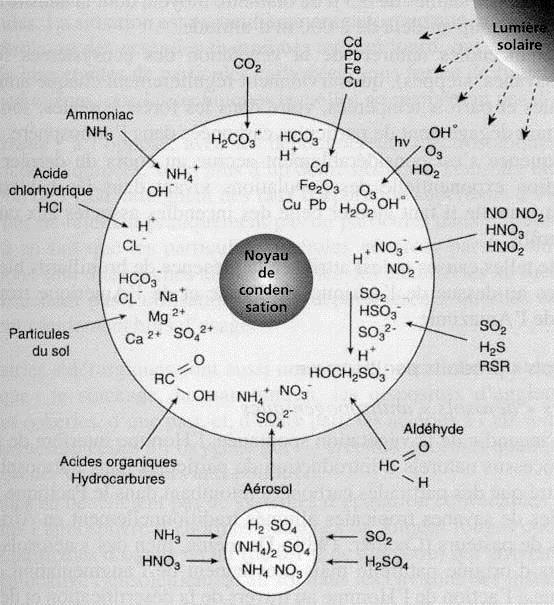 La concentration en aérosols présente de fortes variations en fonction de la latitude et de façon plus générale selon la localisation géographique. Il existe dans l’écosphère de vastes zones où l’air est très chargé en particules et à l’opposé d’autres où celles-ci peuvent être quasi absentes.
La concentration en aérosols présente de fortes variations en fonction de la latitude et de façon plus générale selon la localisation géographique. Il existe dans l’écosphère de vastes zones où l’air est très chargé en particules et à l’opposé d’autres où celles-ci peuvent être quasi absentes.
Dans la troposphère, les principales sources naturelles de particules solides sont le volcanisme et l’érosion éolienne. C’est à cette dernière qu’il faut attribuer la genèse des immenses voiles de poussières de couleur brun rouge qui s’observent au-dessus du Sahara, du Moyen-Orient, de l’Inde et de la Chine continentale. Ces aérosols sahariens sont la cause des pluies de boue observées épisodiquement au nord de la Méditerranée et même dans le nord de la France.
Le temps moyen de séjour de ces particules est des plus variables selon le régime des pluies et les chutes de neige aux latitudes considérées. Il est estimé entre 6 jours et 2 semaines dans la basse troposphère au-dessous de 3 000 m, de 2 à 4 semaines au niveau de la tropopause, de 6 mois dans la basse stratosphère, de 3 à 5 ans à la limite de la mésosphère et de 5 à 10 ans dans cette dernière.
Le temps moyen de résidence des particules dans l’ensemble de l’atmosphère a été estimé à 36 jours, ce qui permet d’évaluer à 2 millions de tonnes la quantité instantanée d’aérosols introduits par l’homme.
Les grandes éruptions volcaniques introduisent dans l’atmosphère des masses colossales de matériaux dits pyroclastiques. Parmi eux, les matériaux téphritiques (cendres) dont beaucoup sont de taille micronique ou inframicronique et entrent dans la catégorie des aérosols atmosphériques.
À ces masses rejetées s’ajoutent celles des émissions gazeuses non moins considérables, en particulier le \(SO_2\), lui-même à l’origine d’aérosols sulfuriques dont dérivent au niveau tertiaire des particules constituées par des microcristaux de sulfate d’ammonium.

