1. Introduction
Voici un micro glossaire indispensable (d’après J.F Beaux, Nathan) :
Autotrophie : Mode de nutrition qualifiant les êtres vivants capables de produire leur matière organique à partir de matières uniquement minérales (par exemple les végétaux chlorophylliens).
Biocénose : Ensemble des êtres vivants peuplant un milieu de vie(ou biotope)donné.
Biodiversité : Diversité biologique d’un milieu, estimé par le nombre d’espèces animales et/ou végétales peuplant ce milieu.
Biomasse : Masse des organismes peuplant un biotope donné à l’instant considéré. La biomasse est indiquée en unité de masse par unité de surface.
Biosphère : Ensemble des milieux du globe peuplés par des êtres vivants.
Biotope : Milieu de vie d’un organisme, défini par un ensemble de facteurs physique et chimiques facteur climatique, par exemple).
Écosystème : Ensemble associant un milieu de vie donnée (biotope) et les êtres vivants qui le peuplent (biocénose).
Hétérotrophie : Mode de nutrition qualifiant les êtres vivants ne pouvant produire leur matière organique qu’à partir de matières organiques consommées.
Trophique : Relatif à la nutrition. Les relations trophiques sont les relations alimentaires qui unissent des êtres vivants au sein d’un écosystème donné.
L’interaction continue qui s’exerce entre facteurs abiotiques et organismes vivants d’un écosystème s’accompagne d’une circulation ininterrompue de matière entre biotope et biocénose sous forme de substances alternativement minérales et organiques.
2. Mécanismes généraux des cycles biogéochimiques
Dans chaque écosystème, une complémentarité écophysiologique existe entre autotrophes hétérotrophes. La chose est simple : les métabolismes des êtres vivants sont complémentaires entre production, consommation et décomposition. Une circulation cyclique de la matière s’établit et permet un recyclage permanent des principaux éléments indispensables aux cellules vivantes.
Tous les corps simples indispensables à l’édification de la cellule vivante (carbone, oxygène, azote, etc., près d’une quarantaine) sont sans cesse transformés en matières biochimiques (glucides, lipides, acides aminés, etc.) ou absorbés sous forme d’ions inorganiques par les végétaux autotrophes.
Ils sont ensuite utilisés par les hétérotrophes à savoir les animaux, en n’oubliant pas les microorganismes dégradants. Ce passage alternatif des éléments entre milieu inorganique et matière vivante est un cycle biochimique.
Cette remarquable constance du taux des divers éléments présents dans chaque milieu résulte donc d’un pouvoir d’autorégulation (homéostasie) assurant à la biosphère sa pérennité dans l’écosystème.
3. Principaux types de cycles biogéochimiques
Les principaux types de cycles biogéochimiques concernent principalement l’eau, certains éléments à phase gazeuse et d’autres à phase sédimentaire.
Le premier implique l’étude des mouvements d’un corps composé : l’eau. Ce cycle étant très bien connu, nous ne porterons notre attention que sur les deux autres, et sous forme de notions indispensables pour les situer dans notre environnement quotidien.
3.1. Éléments à phase gazeuse
À l’exception du phosphore, les principaux éléments biogènes présentent une phase gazeuse. De plus, l’atmosphère constitue un stock important de l’élément considéré par rapport au flux circulant.
3.1.1. Cycle du carbone
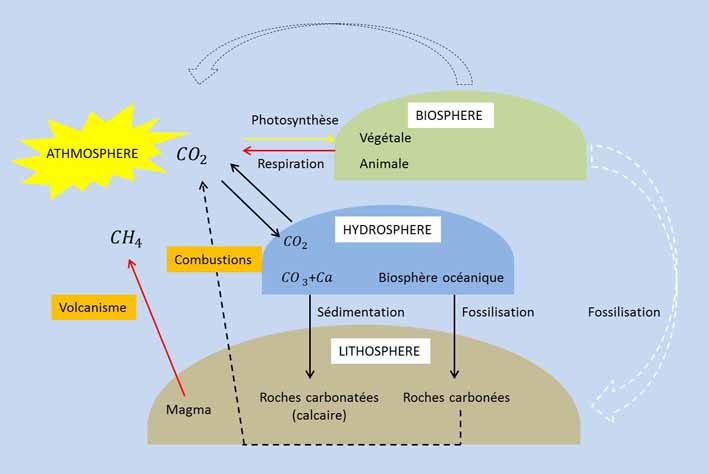 Le carbone est un élément biogène primordial : le cycle du carbone s’effectue avant tout entre le gaz carbonique et les êtres vivants.
Le carbone est un élément biogène primordial : le cycle du carbone s’effectue avant tout entre le gaz carbonique et les êtres vivants.
Première forme prépondérante : la forme minérale
La forme minérale du carbone est essentiellement du carbone à l’état de carbonate et de roches calcaires d’origine biogène (dépôts dans certaines zones de la lithosphère). L’hydrocarbure fossile ne se rencontrant pas dans les roches superficielles n’interfère pas dans les conditions naturelles avec le cycle. Il correspond au contraire à cet épicycle qui s’est accompagné de la mise en circulation, au cours des temps géologiques, d’une grande partie du carbone présent dans la biosphère.
Deuxième forme prépondérante : la forme gazeuse
L’anhydride carbonique \(CO_2\) est la principale molécule par laquelle le carbone inorganique circule dans la biosphère. Majeur dans l’ajustement des climats, il représente avec la vapeur d’eau le principal gaz de serre présent dans l’atmosphère terrestre.
La teneur en \(CO_2\) de l’atmosphère (371 ppm) s’est accrue en moyenne d’environ 1,5 ppm par an au cours de la période 1980 - 2002 par suite de rejets anthropogènes dus surtout à l’usage des combustibles fossiles, mais aussi à la déforestation.
En première approximation, le taux de gaz carbonique atmosphérique apparaît constant. Cela suppose une grande mobilité du carbone ainsi que la présence d’un autre réservoir que l’atmosphère jouant un rôle régulateur dans la circulation du gaz carbonique. Ce réservoir est l’océan : la teneur en \(CO_2\) dans les eaux marines (principalement à l’état de bicarbonates) est équivalente à 180 fois la masse totale du \(CO_2\) atmosphérique.
Les échanges de \(CO_2\) entre atmosphère hydrosphère, et lithosphère se traduisent par l’ensemble de réactions suivantes :
\[\begin{aligned} &CO_2\quad \text{atmosphérique}\\ &\downarrow\uparrow \\ &CO_2 \quad \longleftrightarrow \quad CO_2+H_2O \quad \longleftrightarrow \quad CO_3^{2-}+2H^+\end{aligned}\]
Dans le cas des carbonates, comme le calcaire par exemple, il se produit une remise en circulation du calcium sous forme de bicarbonate (carbonate acide) soluble dans l’eau :
\[\begin{aligned} &&CO_2+H_2O+CaCO_3 &&\longleftrightarrow && CaH_2(CO_3)_2&& \\ && \text{carbonate} && && \text{ bicarbonate} &&\end{aligned}\]
Le bicarbonate produit est entrainé par les eaux superficielles de ruissellement vers les océans. Il y sera précipité sous forme de calcite et d’aragonite dans la coquille ou l’exosquelette de nombreux invertébrés marins. De là, proviennent les dépôts sédimentaires de carbonates.
Rôle des phénomènes abiotiques dans le cycle du carbone
Ces phénomènes peuvent expliquer en grande partie les changements de la concentration en \(CO_2\) atmosphérique observés sur une longue période de temps. En effet, la dissolution dans l’océan du \(CO_2\) atmosphérique sous forme de bicarbonates diminue avec sa concentration dans l’air.
Après un certain temps dans les couches lithosphériques profondes, les carbonates d’origine squelettique animale se transforment en silicates avec dégagement de \(CO_2\) sous l’effet conjugué du réchauffement et de la compression.
Ce phénomène de couplage des cycles du carbone et du silicium qui correspondrait à un cycle d’une période de 500 000 ans est susceptible de contribuer à l’explication partielle des fluctuations climatiques observées au cours des périodes géologiques passées.
Principaux flux et stocks de \(CO_2\) dans la biosphère
À l’origine, deux phénomènes biologiques fondamentaux conditionnent et régulent la circulation du carbone dans la biosphère : la photosynthèse et la respiration. La quantité de \(CO_2\) absorbée par la photosynthèse en milieu continental était considérée comme entièrement consommée par la respiration des communautés terrestres.
Au quaternaire récent, en l’absence d’intervention humaine, le cycle était équilibré. L’anhydride carbonique atmosphérique et celui dissous dans les eaux constituent l’unique source de carbone inorganique à partir de laquelle s’élaborent toutes les substances biochimiques constituant la cellule vivante grâce à l’assimilation chlorophyllienne.
Dans le cycle du carbone, on distingue toujours les biosphères continentale et océanique. En effet, pris sur une faible durée du temps, ce cycle s’effectue de façon relativement disjointe dans chacun de ces compartiments de la biosphère.
L’atmosphère renferme 712 milliards de tonnes d’équivalent carbone de sorte que le flux photosynthétique annuel des biomes continentaux correspond à environ 9 % du stock gazeux de \(CO_2\) atmosphérique, le rapport production synthétique brute sur biomasse continentale étant lui-même égal à environ 12 %.
La majorité du stock de carbone organique continental est contenu dans la végétation. La biomasse terrestre actuelle (biomasse végétale sur pied) est estimée à 700 milliards de tonnes. Cette dernière est significativement inférieure à celle qui existait au début du néolithique, estimée à environ 1 100 milliards de tonnes. La cause en est essentiellement une déforestation considérable et de façon générale la destruction accrue de la végétation naturelle.
Le stock gazeux \(CO_2\) atmosphérique est de l’ordre de 10 %.
Blocage du cycle du carbone et fossilisation
En milieu terrestre, les matières organiques ne sont pas entièrement minéralisées, mais transformées en un ensemble complexe de composés organiques acides formant une masse de couleur sombre : l’humus, complexe absorbant du sol, qui joue un rôle fondamental dans la rétention et la circulation des sels minéraux nutritifs.
Échanges de carbone entre compartiments de la biosphère
Il existe par ailleurs un certain découplage entre le cycle du carbone dans les écosystèmes continentaux et dans l’océan. Alors que les échanges de \(CO_2\) entre l’air et les biocénoses terrestres sont relativement rapides, ceux entre hydrosphère et atmosphère sont au contraire plus lents.
L’océan mondial fonctionne en autonomie de \(CO_2\) nécessaire à sa production primaire. Il en renferme un stock considérable de sorte que ce gaz y est largement en excès et ne constitue pas un facteur limitant pour la photosynthèse en milieu aquatique.
Il existe cependant des échanges abiotiques de carbone entre les trois compartiments de la biosphère : dissolution ou dégazage du CO2 à l’interface océan – atmosphère, entraînement de bicarbonates des continents vers l’hydrosphère par suite des phénomènes de dissolution et par le jeu du cycle de l’eau, sédimentation de des carbonates, mais aussi d’une partie de la matière organique morte au fond de l’océan.
Des études sur le devenir du \(^{14}CO_2\) produit par les essais aériens d’engins nucléaires et sur l’effet Suess ont montré que les couches superficielles de l’océan extraient de l’atmosphère une fraction importante du \(CO_2\) rejeté par l’homme par les combustions. Donc, depuis la fin de la dernière glaciation jusqu’à l’avènement de la société industrielle moderne, le cycle du carbone était pratiquement parfait.
3.1.2. Cycle de l’oxygène
L’oxygène est quantitativement le principal constituant de la matière vivante : en tenant compte de l’eau présente dans les tissus, le corps humain renferme par exemple 62,8 % d’oxygène et 19,4% de carbone.
Le cycle de l’oxygène est fort compliqué, par suite de son aptitude à donner de multiples combinaisons chimiques et à se présenter sous diverses formes. Il en résulte l’existence de nombreux épicycles.
L’oxygène était absent de l’atmosphère terrestre primitive. Ce sont les organismes autotrophes qui l’ont élaboré : l’oxygène atmosphérique et de nombreuses roches superficielles (sédiments calcaires, dépôts ferrugineux) sont d’origine biogène.
Selon Mjosis (1996) la production photosynthétique de l’oxygène a commencé il y a probablement 4 milliards d’années, à la fin de la condensation de l’océan mondial dès qu’apparurent les premiers microorganismes photosynthétiques, l’oxygène diffusant dans l’atmosphère.
Cependant, le taux d’oxygène est resté probablement à un niveau inférieur à 1 %, valeur atteinte vers -2,5 milliards d’années. C’est seulement à partir de cette concentration que la couche d’ozone stratosphérique commence à se former et que le taux d’oxygène dissous se met à croître dans les eaux océaniques.
La filtration de plus en plus efficace du rayonnement UV par l’augmentation de l’importance de l’écran d’ozone a permis aux eucaryotes autotrophes de se développer dans les couches superficielles des eaux, là où le flux solaire est le plus intense, d’où l’accroissement de l’intensité de la photosynthèse et donc de la production d’oxygène.
Bien que l’oxygène moléculaire puisse se former par dissociation de la molécule d’eau dans la haute atmosphère, sous l’effet des radiations à haute énergie, l’oxygène atmosphérique peut être considéré en définitive comme d’origine essentiellement biogène. Le cycle de l’oxygène s’effectue d’ailleurs en majeure partie entre l’atmosphère et les êtres vivants. Il apparaît en grande partie comme l’image inversée de celui du gaz carbonique.
La consommation de l’oxygène atmosphérique et son renouvellement par les producteurs primaires s’effectuent à un rythme assez rapide. On estime actuellement que l’oxygène produit par la photosynthèse est recyclé en 2 000 ans. En revanche, il faut plus de 2 millions d’années pour que toutes les molécules d’eau de l’hydrosphère soient photolysées et resynthétisées par les êtres vivants. Quant à l’anhydride carbonique atmosphérique, son temps moyen de résidence dans l’atmosphère est de l’ordre d’environ 300 ans.
Actuellement, dans les conditions naturelles – et si l’on exclut l’action de l’homme –, photosynthèse et respiration sont rigoureusement équilibrées, de sorte qu’il ne se produit plus d’accumulation d’oxygène dans l’atmosphère et que le taux d’oxygène libre demeure constant.
3.1.3. Cycle de l’azote
Le cycle de l’azote est certainement un des cycles les plus complexes et les plus parfaits à la fois. Cependant, malgré le grand nombre et la diversité des organismes qui interviennent, il assure une circulation rapide de l’azote dans les divers écosystèmes. Cet élément suit dans une grande mesure le carbone avec lequel il est associé dans toutes les substances protéiques. Cependant, il en diffère par plusieurs points essentiels.
Par exemple, alors que les produits de dégradation des composés carbonés sont finalement rejetés sous forme d’anhydride carbonique \(CO_2\), il n’en est pas de même pour l’azote dont une faible quantité seulement est directement éliminée sous forme gazeuse.
Nitrification
Le principal réservoir d’azote est l’atmosphère, qui en renferme 78 % en volume et 75,5 % en masse.
Si la formation de nitrates par voie inorganique s’effectue sans cesse dans l’atmosphère par suite des décharges électriques lors des orages, elle ne joue cependant qu’un rôle secondaire par rapport à celui des microorganismes nitrifiants. La fixation biosphérique d’azote moléculaire résulte essentiellement de l’action de certaines bactéries (surtout hétérotrophes) et des cyanophycées (algues bleues) qui sont toutes capables de fixer ce gaz et de le transformer en nitrates.
Il existe à l’image du cycle du carbone une disjonction entre le cycle de cet élément en milieu continental et dans l’hydrosphère. Ici, la connexion entre ces deux compartiments de la biosphère s’effectue de façon univoque par le jeu du ruissellement qui introduit des sels azotés des terres émergées dans les eaux continentales et marines. Ce cycle est actuellement perturbé par un excès de nitrification lié à la synthèse industrielle d’engrais.
Nitrification dans les sols
Dans les écosystèmes terrestres, la nitrification est le fait de divers genres de bactéries, certaines libres qui se rencontrent aussi bien dans les sols que dans les eaux, ou d’autres bactéries autotrophes à la différence des précédentes. Cependant, les plus puissants fixateurs de l’azote sont incontestablement les bactéries symbiotiques des lumineuses.
Nitrification en milieu aquatique
En milieu marin, la fixation de l’azote est essentiellement le fait de cyanobactéries autotrophes.
Ammonification
Le cycle de l’azote se poursuit au niveau des décomposeurs, car une partie de cet élément, contenu dans la biomasse, est sans cesse restitué au milieu sous forme de matière organique morte contenue dans la litière, et autres détritus végétaux, les excréta, de cadavres. Les protéines et autres formes d’azote organique contenues dans ces déchets vont être attaqués par des microorganismes bioréducteurs (bactéries hétérotrophes, champignons), lesquels produisent l’énergie dont ils ont besoin par la décomposition de cet azote organique qui, en dernier lieu, et transformé en \(NH_4^+\).
Cette ammonification de l’azote protéique est le fait de microorganismes souvent spécialisés. Certains agents ammonifiants sont capables d’utiliser des peptones et non des acides aminés, d’autres ne survivent qu’aux dépens de l’urée et non de l’acide urique etc. Une partie de cet azote ammoniacal pénètre directement dans les végétaux au niveau racinaire pour être transformés en protéines.
Une fraction de l’azote ammoniacale non absorbée par les végétaux autotrophes peut aussi être utilisée par des bactéries nitrifiantes pour produire leur énergie métabollique.
Nitrosation et nitratation
Diverses bactéries des sols et des eaux peuvent aussi retransformer l’ammoniac provenant de la dégradation des matières organiques mortes en nitrites puis en nitrates. La nitrification s’effectuant selon cette voie comporte deux étapes : la nitrosation qui conduit à la formation de nitrite \(NO_2^-\) et la nitratation qui oxyde l’ion nitrite en nitrate \(NO_3^-\). La nitrosation est le fait de diverses bactéries. Elle s’effectue suivant la réaction : \[NH_4^+ + \frac{3}{2}~O_2 \quad \longrightarrow \quad NO_2^- + H_2O \qquad\qquad \Delta G = 276~kJ\]
Ultérieurement, les bactéries nitrifiantes transforment les nitrites en nitrates selon la réaction : \[NO_2^- + \frac{1}{2}~O_2 \quad \longrightarrow \quad NO_3^- \qquad\qquad\qquad \Delta G = -75~kJ\]
Synthèse de l’azote organique
Les nitrates sont assimilés par les organismes autotrophes à partir desquels ces derniers synthétisent les acides aminés qui leur sont indispensables. L’azote nitrique ainsi élaboré par ces nombreux microorganismes terrestres ou aquatiques est finalement absorbé par les végétaux, emmené dans les feuilles et réduit par les \(NADPH_2\) et \(NADH_2\) en \(NH_4^+\), grâce à une enzyme spécifique, le nitrate réductase.
Il convient cependant de noter que les plantes vertes terrestres ou le phytoplancton en milieu aquatique absorbent aussi directement l’ion ammonium contenu dans les sols ou les eaux naturelles. Fait souvent négligé, l’absorption directe de l’ammonium intervient de façon comparable à celle des nitrates, voire même prépondérante dans la nutrition azotée des plantes.
Ensuite, en présence d’acides carboxyliques, l’ammonium est finalement transformé en azote aminé puis en protéines selon la réaction : \[NO_3^- ~~\rightarrow~~ NO_2^- ~~\rightarrow~~ NH_4^+ ~~\rightarrow~~ R-CH<\genfrac{}{}{0pt}{}{COOH}{NH_2} ~~\rightarrow~~ \text{Protéines}\]
Cette réaction met aussi en évidence le couplage entre les cycles biogéochimiques de l’azote et du carbone, lequel prend primordialement place au cours de la photosynthèse, au niveau du cycle de Calvin où se situe le paracycle conduisant à la synthèse des acides aminés.
Dénitrification
La dénitrification se produit dans les sols présentant un excès de nitrate. Cependant, la plupart des agents dénitrifiants arrêtent leur action au stade nitrite ou ammonium. La réaction du nitrate sur le glucose avec formation de nitrite, fournit quelque 595 kcal/mol de glucose, ce qui est largement suffisant pour subvenir aux besoins énergétiques de ces organismes dénitrifiants.
Il convient de préciser que, même dans les sols très riches en nitrates et en carbone, seulement 20 % de l’azote total est ainsi décomposé. En fait, une fraction importante de l’azote reste dans les sols et les eaux sous forme d’azote organique contenu dans les matières végétales et animales mortes.
En milieu marin existe une disjonction entre nitrification et dénitrification. En effet, la matière organique morte se sédimente souvent très loin des zones où les nitrates se sont formés. Cela conduit à une accumulation de l’azote organique dans les sédiments où se constitue une réserve profonde de nitrates. Les upwellings les ramèneront ensuite dans les eaux superficielles.
Enfin, il existe des apports d’azote à l’atmosphère par le volcanisme qui compensent les pertes dues à la mise hors circulation d’azote par sédimentation au fond des abysses.
Blocage du cycle de l’azote
Par suite de la forte solubilité de ses diverses formes inorganiques, l’azote se prête mal à la fossilisation. Il existe cependant en de rares circonstances une stase du cycle de l’azote. Cette dernière s’observe par exemple le long de certaines côtes désertiques où les matières organiques mortes ne peuvent être décomposées par suite de la quasi-inexistence de l’eau. De telles conditions ont donné lieu à la constitution de gisements de guano.
Bilan du cycle de l’azote
On peut en définitive distinguer plusieurs paracycles dans le cycle de l’azote qui peuvent se réunir en deux types majeurs :
-
des cycles courts qui s’effectuent à l’échelle du biotope voire de microhabitats et qui correspondent au recyclage in situ sous formes de nitrates et d’ammoniac de l’azote contenu par les matières organiques mortes. À cela s’ajoute l’azote nitrique produit de novo par les microorganismes libres ou symbiotiques fixateurs de l’azote ;
-
des cycles longs qui s’effectuent à l’échelle de la biosphère toute entière et correspondent à la fois à l’azote fixé dans l’océan mondial et les dérivés minéraux qui y sont amenés par les apports terrigènes.
En conclusion, l’existence de nombreux paracycles, si elle est un facteur de complication du cycle de l’azote, a aussi conduit à une remarquable homéostasie dans la circulation de cet élément. Les processus majeurs de nitrification et dénitrification sont magnifiquement adaptés – dans les conditions naturelles – pour répondre aux besoins de productivité des écosystèmes.
3.2. Cycles biochimiques sédimentaires
Dans cette étude succincte, nous ne retiendrons que deux éléments : le cycle du soufre et celui du phosphore
Cycle du soufre
La majeure partie du cycle du soufre est de nature sédimentaire et s’effectue dans les eaux et les sols. Le cycle du soufre est considéré comme équilibré en l’absence d’action humaine : les stocks et les flux sont sensiblement constants dans et entre les divers compartiments de la biosphère. En particulier, il existe une relation d’équivalence entre les quantités dissoutes dans les eaux courantes ou rejetées dans l’atmosphère d’une part et celles qui retournent à la surface du sol et sont sédimentées dans les écosystèmes aquatiques continentaux ou océaniques de l’autre.
La principale source de soufre disponible pour les êtres vivants est constituée par les sulfates. La solubilité dans l’eau de nombreux sulfates en fait l’unique forme de soufre élémentaire, inorganique, disponible pour les écosystèmes. Les sulfates sont absorbés par les plantes qui les réduisent et élaborent des aminoacides soufrés.
Dans les conditions naturelles, trois types de phénomènes biogéochimiques introduisent diverses formes du soufre dans l’atmosphère : la formation d’embruns marins ; le volcanisme ; les fermentations dans les sols marécageux, dans les vases des zones humides et dans les sédiments marins littoraux et abyssaux.
La formation d’embruns marins lorsque l’océan est agité introduit des sulfates dans l’atmosphère. Le volcanisme constitue une autre cause, elle, abiotique, de dégagement de dérivés gazeux du soufre (\(SO_2\), \(H_2S\)) dans l’atmosphère bien que son importance soit cependant inférieure à celle provenant des microorganismes sulfatoréducteurs. On estime au total que le volcanisme dégagerait en moyenne 28 millions de tonnes de soufre, principalement sous forme de \(SO_2\) dans l’atmosphère.
Cycle du phosphore
Le phosphore est essentiel à la fabrication des acides nucléiques (ADN, ARN). Il est important pour la vie et se retrouve d’ailleurs dans les squelettes des organismes sous forme de phosphate \(PO_4\).
Ne possédant pas de phase gazeuse en quantité significative, il n’affecte pas l’atmosphère. C’est avec l’activité humaine que son effet polluant se manifeste de manière sensible(drainage vers les systèmes aquatiques) contribuant parfois au phénomène d’eutropisation de nos lacs de montagne. On entendra dire par exemple que tel lac, d’une profondeur de 5 mètres, avait en une profondeur de 8 ou 10 mètres au siècle dernier. La différence venant de l’épaisseur de vase qui tapisse la cuvette du lac en question.

