1. Étude générale
Nous avons implicitement admis jusqu’ici que la célérité des ondes sonores est, pour un état donné du fluide (défini par sa température et sa pression de repos), une constante indépendante en particulier de la fréquence de la vibration transportée.
Ceci semble résulter de l’expression \(c=\dfrac{1}{\sqrt{\chi~\rho_0}}\) dans laquelle semblent n’intervenir que des quantités (masse spécifique au repos et coefficient de compressibilité adiabatique) qui ne dépendent que de l’état de repos et non de la nature de la vibration elle-même.
Pour un gaz parfait par exemple, la célérité prend l’expression \(c=\sqrt{\cfrac{\gamma~r~T}{M}}\) et il semble donc bien qu’elle ne puisse dépendre que de la température \(T\).
L’expérience montre cependant que la célérité ne peut être considérée comme indépendante de la fréquence que dans le cas des gaz monoatomiques pour lesquels \(\gamma=5/3\). Pour un gaz diatomique comme l’air par exemple, la célérité \(c\), qui, aux fréquences moyennes est inférieure (\(\gamma=7/5\)) à la valeur qu’elle prend à la même température que pour un gaz monoatomique, s’élève lorsque la fréquence atteint une valeur élevée (quelques centaines de kilohertz) pour atteindre aux très hautes fréquences la valeur qui correspond à un gaz monoatomique.
Dans la bande de fréquences où se produit la transition, la célérité varie donc avec la fréquence : on dit qu’il y a dispersion (par analogie avec la dispersion d’un prisme pour les ondes lumineuses, qui provient précisément d’une variation de l’indice, c’est à dire de la vitesse de propagation de la lumière dans le verre, avec la fréquence des diverses composantes monochromatiques).
L’expérience montre en outre que la dispersion s’accompagne d’une absorption importante des ondes sonores au cours de leur propagation, absorption qui ne peut être interprétée par la simple considération des phénomènes de viscosité et d’échanges thermiques entre couches gazeuses (de températures différentes du fait de leur compression différente).
Ces divers phénomènes peuvent s’interpréter si l’on considère que les transformations thermodynamiques subies par le gaz sont loin d’être des transformations quasi-statiques pour lesquelles la loi de Laplace : \[\frac{dp}{p}+\gamma~\frac{dv}{v}=0\] s’applique rigoureusement dès que le gaz peut être considéré comme un gaz parfait.
La validité de la loi de Laplace exige en effet que les états successivement parcourus par le gaz soient des états d’équilibre thermodynamique, c’est-à-dire des états dans lesquels l’équilibre thermique a eu notamment le temps de s’établir entre les diverses formes d’énergie présentes dans le gaz.
2. Impact de la fréquence des ondes sonores
Considérons un gaz diatomique et faisons-lui subir une compression adiabatique brutale ; toute l’énergie dépensée pour la compression sert uniquement à accroître de façon quasi-instantanée l’énergie cinétique de translation des molécules. L’élévation instantanée de pression (qui dépend uniquement de l’énergie de translation et du volume spécifique) est donc la même que si le gaz était monoatomique pour lequel seule l’énergie cinétique de translation est susceptible de varier.
Ce n’est qu’au bout d’un certain temps de relaxation que l’énergie cinétique de rotation par exemple, qui n’avait pas eu le temps de varier pendant la compression, va s’accroître aux dépends de l’énergie cinétique de translation avec laquelle elle se met à l’équilibre thermique ; d’où un léger abaissement de la pression qui passe donc en définitive :
D’abord à une valeur sensiblement égale à celle qui serait atteinte pour un gaz monoatomique subissant la même variation relative de volume. Ensuite seulement à la valeur définitive correspondant à l’atomicité réelle du gaz.
Il devient ainsi évident que, si la fréquence est assez élevée pour que les variations de l’énergie cinétique de rotation (et d’autres formes autres que l’énergie de translation) n’aient pas le temps de suivre les rapides variations du volume spécifique, le gaz se comporte comme un gaz monoatomique : la célérité des ondes est donc celle qui correspond à \(\gamma=5/3\).
– Aux basses fréquences, l’équilibre thermique est au contraire constamment respecté entre les diverse formes d’énergie et le \(\gamma\) à prendre en considération pour le calcul de la célérité est bien celui qui correspond à une compression quasi-statique, soit par exemple 7/5 dans le cas de l’air.
– Aux fréquences intermédiaires, la célérité passe progressivement de la valeur \(c_1\) des basses fréquences à la valeur \(c_2~(\gamma=5/3)\) des hautes fréquences : il y a donc dispersion dans une certaine bande de fréquences.
L’existence d’un temps de relaxation non nul pour la thermalisation des diverses formes d’énergie permet de comprendre immédiatement pourquoi une absorption importante doit nécessairement accompagner la dispersion. On sait en effet qu’une transformation peut être considérée comme réversible dans deux cas opposés :
-
ou bien si la vitesse de retour à l’équilibre du système perturbé est infiniment grande devant la vitesse de transformation : on est alors dans le cas d’une transformation quasi-statique où l’équilibre thermodynamique se maintient constamment ;
-
ou bien au contraire si, la transformation étant cyclique, la vitesse de retour à l’équilibre du système perturbé est infiniment petite devant la vitesse de transformation ; tout se passe alors comme si la transformation était une transformation à modifications internes entravées joignant une suite fermée d’états d’équilibre métastables.
Tant que les transformations subies par les divers éléments du gaz peuvent être considérées comme réversibles, c’est-à-dire aux basses fréquences ou aux très hautes fréquences, la production d’entropie est nulle et il n’y a par suite pas de transformation d’énergie mécanique en chaleur, donc pas d’absorption de l’onde sonore.
Par contre, aux fréquences telles que la période de l’onde soit de l’ordre de grandeur du temps de relaxation nécessaire à la mise à l’équilibre thermique des diverse formes d’énergie, les modifications seront irréversibles : d’où une absorption plus ou moins importante des ondes sonores au cours de leur propagation.
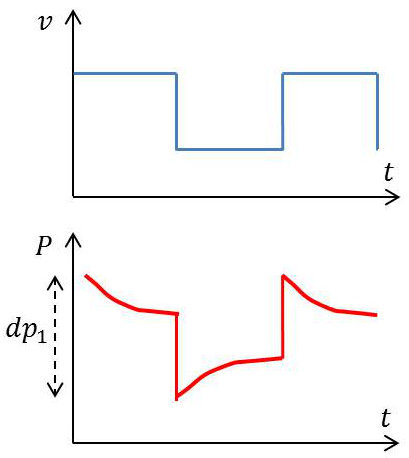 La figure ci-contre illustre les transformations subies par une masse \(dm\) de gaz lorsque sa période de vibration est de l’ordre de grandeur du temps de relaxation (c’est-à-dire dans la bande de dispersion) ; on a choisi pour simplifier le diagramme le cas d’un signal en créneaux.
La figure ci-contre illustre les transformations subies par une masse \(dm\) de gaz lorsque sa période de vibration est de l’ordre de grandeur du temps de relaxation (c’est-à-dire dans la bande de dispersion) ; on a choisi pour simplifier le diagramme le cas d’un signal en créneaux.
La variation brutale de volume entraîne immédiatement une variation brutale de pression telle que : \[\frac{dp_1}{p_1}=-\frac{5}{3}~\frac{dv}{v}\]
Pendant la demi-période où le volume reste constant, \(p\) se rapproche progressivement de la valeur qu’elle aurait atteinte pour une variation de volume \(dv\) conduite de façon quasi-statique ; et ainsi de suite, d’où la courbe de variation de \(p\) représentée.
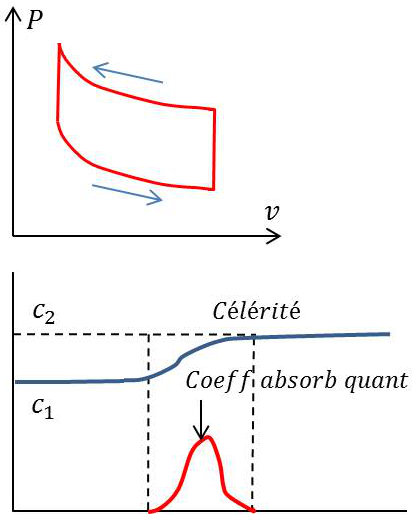 La figure suivante à droite représente la transformation subie par la masse \(dm\) de gaz dans le diagramme de Clapeyron.
La figure suivante à droite représente la transformation subie par la masse \(dm\) de gaz dans le diagramme de Clapeyron.
Le cycle représente une surface non nulle (alors qu’il se réduirait à un segment pour une fréquence très élevée ou très basse) et le sens de circulation est bien entendu, en vertu du second principe de la thermodynamique (accroissement de l’entropie), celui qui correspond à l’absorption par le gaz d’un travail positif. D’où absorption de l’onde dont l’énergie vibratoire se transforme progressivement en énergie interne de repos pour le gaz.
La deuxième figure indique l’allure de la variation avec la fréquence de la célérité \(c\) et du coefficient d’absorption introduit par la dispersion. Cette absorption (désignée parfois sous le nom d’absorption quantique, les rotations et vibrations étant quantifiées) se superpose bien entendu à l’absorption relativement faible qui provient des pertes par viscosité et par conductibilité thermique entraînant touts deux des accroissements d’entropie.

